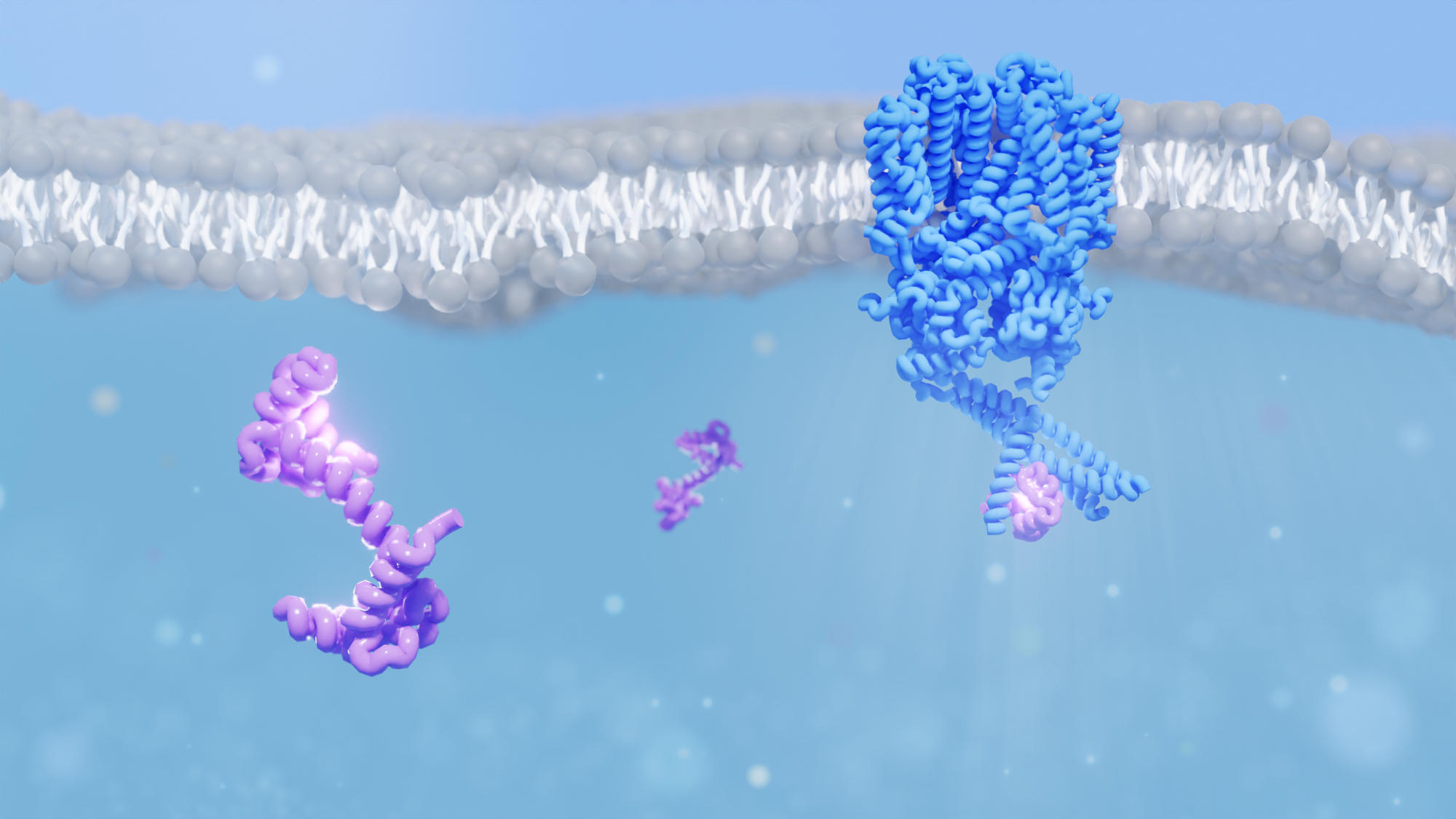
Los investigadores descifraron la estructura de un canal iónico de los bastones del ojo (que se muestra en azul) cuando interactúa con la proteína calmodulina (púrpura). Esta interacción es importante para la función no solo del canal de iones en el ojo, sino también de los canales de iones en otras partes del cuerpo, como el corazón. Crédito: Instituto Paul Scherrer / Dina Schuster
Nuevos descubrimientos emocionantes arrojan luz sobre la interacción entre la proteína calmodulina y un canal de iones en el ojo, lo que potencialmente revela el secreto detrás de la excepcional sensibilidad de nuestros ojos a las condiciones de poca luz.
Usando microscopía crioelectrónica y espectrometría de masas, un equipo de investigadores de PSI ha logrado desentrañar la estructura de un canal de iones en el ojo cuando interactúa con la proteína calmodulina, un rompecabezas que ha intrigado a los científicos durante 30 años. Esta interacción podría explicar cómo nuestros ojos pueden lograr una sensibilidad tan notable a la luz tenue. Los resultados fueron publicados en la revista PNAS.
Cuando miras la pantalla brillante de tu teléfono o computadora, los canales de iones en tus ojos reaccionan a la luz cerrándose. Esta acción marca la culminación de una reacción en cadena bioquímica iniciada por la exposición a la luz. Como resultado, los iones de calcio ya no pueden pasar a través de los canales ubicados en la membrana celular, lo que conduce a la transformación de la señal bioquímica en una señal eléctrica. Esta señal luego viaja a través del sistema nervioso y finalmente llega al cerebro para su procesamiento.
El mismo proceso ocurre cuando te paras afuera por la noche y miras hacia el cielo. Ahora, las células de varilla realizan este truco. Estas son las células que hacen que nuestros ojos sean sensibles a los bajos niveles de luz, permitiéndonos mirar el cielo nocturno y detectar solo unos pocos fotones de luz de una estrella distante. Lo damos por sentado, pero esta es una hazaña notable.
Un equipo dirigido por el científico de PSI, Jacopo Marino, ahora ha mejorado nuestra comprensión de cómo una pequeña proteína llamada calmodulina ayuda a lograr esto al interactuar con los canales iónicos en las células de varilla. La calmodulina es un sensor de calcio. Permite que la célula responda a las fluctuaciones del calcio, uno de los medios de comunicación universales de la célula. El equipo, una colaboración entre grupos de PSI, ETH Zurich y la Universidad de Bonn, iluminó por primera vez la estructura tridimensional del canal iónico del nucleótido cíclico (CNG) cuando se une a la calmodulina.
Una función importante para la calmodulina en el ojo
Hace un año, los investigadores lograron descifrar la estructura de este mismo canal iónico, que se encuentra en los bastoncillos de la retina de una vaca e idéntico al canal iónico que se encuentra en los bastoncillos de nuestros ojos. Rod CNG consta de cuatro subunidades, una estructura compartida con muchos otros canales iónicos. Pero una peculiaridad del canal es que tres subunidades, conocidas como la subunidad A, son idénticas, mientras que una cuarta, la subunidad B, es diferente.
Los científicos saben desde hace tiempo que esta subunidad se une a la calmodulina. En todo el reino animal, se encuentra esta característica. Sin embargo, la naturaleza exacta de su papel sigue sin estar clara. «Si algo se conserva a través de la evolución, es un indicador muy fuerte de que es importante de alguna manera», explica Marino. «Sabíamos que la calmodulina modula la actividad del canal a través de la subunidad B, pero el tipo de cambios estructurales que estaban ocurriendo ha sido un gran misterio durante unos treinta años, principalmente porque las personas no pudieron resolver la estructura del ion. canal».
Ahora, los investigadores pueden proporcionar una vista tridimensional de lo que realmente está sucediendo. A través de una combinación de microscopía crioelectrónica y espectrometría de masas, pudieron observar que cuando la calmodulina se une, el canal iónico se vuelve un poco más compacto.
Los investigadores creen que esta es la forma en que la naturaleza mantiene los canales cerrados. ¿Cuál sería el propósito de esto? «Creemos que es una forma de reducir las aperturas espontáneas de canales que causarían ruido de fondo para que nuestros ojos sean sensibles a la luz tenue», dice Marino.
La espectrometría de masas ayuda a los investigadores a resolver una estructura retorcida
Obtener la estructura de la calmodulina y la unión del canal iónico no fue fácil. La interacción entre calmodulina y Rod CNG ocurre en una región altamente flexible del canal, donde puede oscilar libremente. En microscopía crioelectrónica, esto hace que sea muy difícil obtener información estructural de alta resolución. Aquí, Marino ofrece una analogía: “Imagina que tienes una habitación con gente bailando. Tomas una foto y quieres entender cuál es la forma del cuerpo humano. Es posible que puedas decir cómo se ve una cabeza, pero con las extremidades ondeando por todas partes, las piernas y los brazos estarán borrosos.
Fue gracias a un encuentro casual que el equipo pudo definir esta estructura enrevesada. La estudiante de doctorado Dina Schuster escuchó una presentación de Marino. “Estábamos listos para publicar basándonos únicamente en datos de microscopía crioelectrónica, lo que dejó gran parte de la interacción ambigua, cuando Dina se me acercó y me dijo: ‘Creo que puedo ayudarte’”, recuerda.
Schuster está desarrollando nuevas estrategias basadas en espectrometría de masas para estudiar las interacciones entre proteínas. Estas técnicas utilizan enzimas para cortar proteínas en pedazos, tanto en condiciones nativas dentro de partes de la membrana retinal como cuando se entrecruzan químicamente. Los fragmentos de proteína, algunos de los cuales están unidos entre sí, se identifican mediante espectrometría de masas. Esto revela información sobre qué partes de la proteína estaban juntas en un espacio tridimensional, el equivalente a juntar las piezas de un rompecabezas en 3D. «Estas técnicas nos permitieron reducir algunas de las posibilidades que eran ambiguas con la microscopía crioelectrónica», explica Schuster, quien es el primer autor de la publicación junto con la estudiante de doctorado, Diane Barret.
De la maravilla de la vista a las implicaciones para la salud humana
La calmodulina regula los canales iónicos no solo en el ojo sino en todo el cuerpo, controlando señales eléctricas esenciales para el correcto funcionamiento de diferentes músculos y órganos. Se ha hecho evidente en los últimos años que cuando esta interacción sale mal debido a mutaciones en el gen de la calmodulina, puede haber implicaciones graves para la salud, como insuficiencia cardíaca, algo que aún no se comprende por completo.
Además de ayudarnos a comprender una maravilla fundamental: cómo podemos ver las estrellas, los resultados de este estudio y los métodos utilizados pueden ayudarnos a comprender la interacción de la calmodulina con los canales iónicos en otras partes del cuerpo.
Referencia: «Básico estructural de la modulación de calmodulina del canal dependiente de nucleótidos cíclicos de varilla» por Diane CA Barret, Dina Schuster, Matthew J. Rodrigues, Alexander Leitner, Paola Picotti, Gebhard FX Schertler, U. Benjamin Kaupp, Volodymyr M. Korkhov y Jacopo Marino, 3 de abril de 2023, procedimientos de la Academia Nacional de Ciencias.
DOI: 10.1073/pnas.2300309120

«Maven de internet exasperantemente humilde. Comunicadora. Fanático dedicado al tocino.»
También te puede interesar
-
Dormir bien el fin de semana puede reducir en una quinta parte el riesgo de sufrir enfermedades cardíacas: estudio | Cardiopatía
-
Una nueva investigación sobre la falla megathrust indica que el próximo gran terremoto puede ser inminente
-
Caso de Mpox reportado en la cárcel del condado de Las Vegas
-
SpaceX lanzará 21 satélites Starlink en el cohete Falcon 9 desde Cabo Cañaveral – Spaceflight Now
-
SpaceX restablece el lanzamiento pospuesto de Polaris Dawn, una misión espacial comercial récord